Inhaltsverzeichnis
Harnsteine
Allgemeines
Fischer & Hoffmann gaben 19781) die Häufigkeit des Auftretens einer Kalzinose bei 4197 Kaninchen im Zeitraum von 1973-1977 mit 3% bei noch nicht abgesetzten Jungkaninchen (0-4 Wochen alt) an, 7% in juvenilen (4 Wochen bis 4 Monate alt) und 17% in adulten Tieren. Mit „Kalzinose“ werden Ablagerungen von Calciumsalzen in Form von amorphem Hydroxylapatit, Calciumphosphat sowie kleineren Mengen von Calciumcarbonat beschrieben.
Bei „Urolithiasis“ handelt es sich um eine Erkrankung, die mit einer Steinbildung (Konkremente) in der Niere bzw. den ableitenden Harnwegen einhergeht. Brühl fand 19892) im Rahmen einer Dissertation ein Durchschnittsalter für die Entstehung von Harnkonkrementen von 3,72 Jahren (0,5-8 Jahre). Der Anteil adipöser Tiere lag bei 16%, eine konkrementbegleitende Harnwegsinfektion wiesen 28% der betroffenen Kaninchen auf. Der schwerste Harnstein wog 25,03 g, das Durchschnittsgewicht betrug 3,74 g.
 Abb. 1: Ausgeschiedener Urin von Kaninchen, die mit arttypischer Nahrung (frische Gräser und Kräuter) versorgt werden, enthält oft überschüssige Calciumverbindungen. Dieser Umstand wird auch als „Kalziurie“ bezeichnetDa Kaninchen Calcium (Ca) nicht bedarfsorientiert aufnehmen sondern in der Menge, wie es in der Nahrung enthalten ist, besteht normalerweise ein Überschuss an diesem Mineral im Körper. Was der Körper davon nicht verwertet, wird über die Niere mit dem Urin ausgeschieden. Der Halter registriert diesen ausgeschiedenen Überschuss an Ca gelegentlich durch typische, weiße Flecken besonders nach dem Trocknen des Urins.
Abb. 1: Ausgeschiedener Urin von Kaninchen, die mit arttypischer Nahrung (frische Gräser und Kräuter) versorgt werden, enthält oft überschüssige Calciumverbindungen. Dieser Umstand wird auch als „Kalziurie“ bezeichnetDa Kaninchen Calcium (Ca) nicht bedarfsorientiert aufnehmen sondern in der Menge, wie es in der Nahrung enthalten ist, besteht normalerweise ein Überschuss an diesem Mineral im Körper. Was der Körper davon nicht verwertet, wird über die Niere mit dem Urin ausgeschieden. Der Halter registriert diesen ausgeschiedenen Überschuss an Ca gelegentlich durch typische, weiße Flecken besonders nach dem Trocknen des Urins.
Klarer Urin ohne Ausfällungen ist bei trächtigen oder säugenden Häsinnen und wachsenden Jungtieren zu verzeichnen, was als Zeichen dafür gilt, dass das gesamte, aufgenommene Calcium verwertet wurde – und zwar entweder für die Versorgung der Föten oder des Nachwuchses bzw. für das Wachstum mit einer gesunden Skelettbildung. Eine Besonderheit des Kaninchens sind die ständig nachwachsenden Zähne, deren Abnutzung durch Neubildung verschiedener, calciumhaltiger Zahnsubstanzen wieder ausgeglichen werden muss.
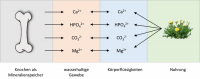 Abb. 2: Im Körper wird das Konzentrationsgleichgewicht von Ionen durch verschiedene, chemisch-physikalische Vorgänge geregelt
Das größte Reservoir für Mineralien wie Ca, P und Mg stellen die Knochen dar, daneben existieren sie in gelöster Form als Ionen in Zellen, Geweben und in Flüssigkeiten. Im Körper herrscht ein Gleichgewicht der Konzentration zwischen den verschiedenen Mineralien. Vor allem das Verhältnis von Ca und P wird durch das Ionenprodukt bestimmt. Steigt die Konzentration des einen, sinkt die Konzentration des anderen und umgekehrt.
Abb. 2: Im Körper wird das Konzentrationsgleichgewicht von Ionen durch verschiedene, chemisch-physikalische Vorgänge geregelt
Das größte Reservoir für Mineralien wie Ca, P und Mg stellen die Knochen dar, daneben existieren sie in gelöster Form als Ionen in Zellen, Geweben und in Flüssigkeiten. Im Körper herrscht ein Gleichgewicht der Konzentration zwischen den verschiedenen Mineralien. Vor allem das Verhältnis von Ca und P wird durch das Ionenprodukt bestimmt. Steigt die Konzentration des einen, sinkt die Konzentration des anderen und umgekehrt.
Entstehung von Harnsteinen
Die Bildung von Harnsteinen ist bis heute nicht restlos aufgeklärt, man weiß, dass sie das Ergebnis komplexer Wechselwirkungen zwischen Ernährungs-, Umwelt-, Stoffwechsel- und genetischen Faktoren ist. Die beste Referenz für ein Verständnis wäre eigentlich das Europäische Wildkaninchen (Oryctolagus cuniculus), dieses wird aber mit seiner Lebens- und Ernährungsweise in Untersuchungen zum Thema „Harnsteinleiden“ nicht mit einbezogen.
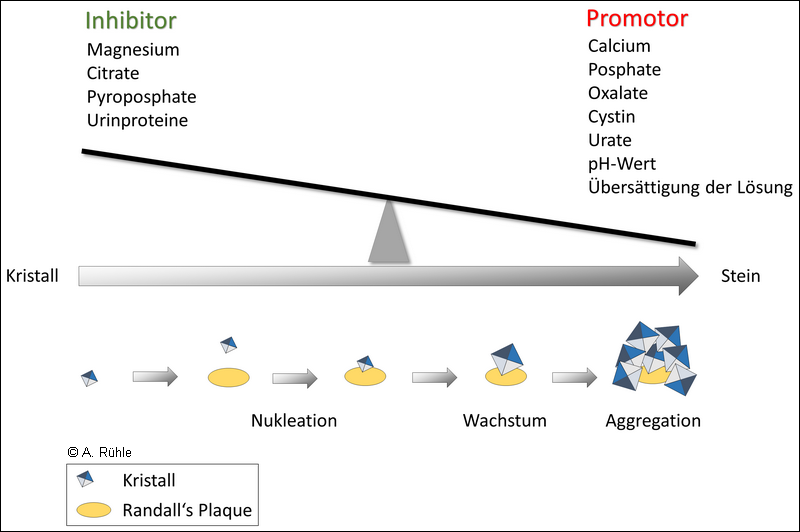
Nach der Kristallisationstheorie beruht die Harnsteinbildung auf einer Kristallisation von Konkrementen bzw. Präzipitaten in einer übersättigten Lösung – das bedeutet, das Löslichkeitsprodukt der kristallbildenden Ionen wurde überschritten.3)
Als zweite geht die Matrixtheorie von einer Steinbildung im Zusammenhang mit dem Vorliegen einer organischen Matrix aus, an die sich Kristalle anlagern und als dritte erklärt die Inhibitormangeltheorie die Entstehung von Harnsteinen aufgrund fehlender Kristallisationshemmer (Inhibitoren). In der Praxis liegt wohl eine Kombination verschiedener Wege der Steinbildung vor, was auch die heterogene Zusammensetzung aus verschiedenen Substanzen der meisten Steine erklärt.
Je nach Form und Auftreten wird unterschieden zwischen einer kristallinen Form (Kristallurie) und festen Formen wie Gries (engl.: sludge, Schlamm) oder einem Harnstein (Urolith). Harnsteine können in der Niere vorkommen (Nephrolith, Nierenstein), im Harnleiter (Ureterolith, Harnleiterstein), in der Harnblase (Urozystolith, Blasenstein) oder in der Harnröhre (Uretrolith). Im Folgenden werden die verschiedenen Konkremente vereinfacht „Harnsteine“ genannt“. Verkalkungen in der Niere werden häufig als „Nephrocalcinose“ bezeichnet.
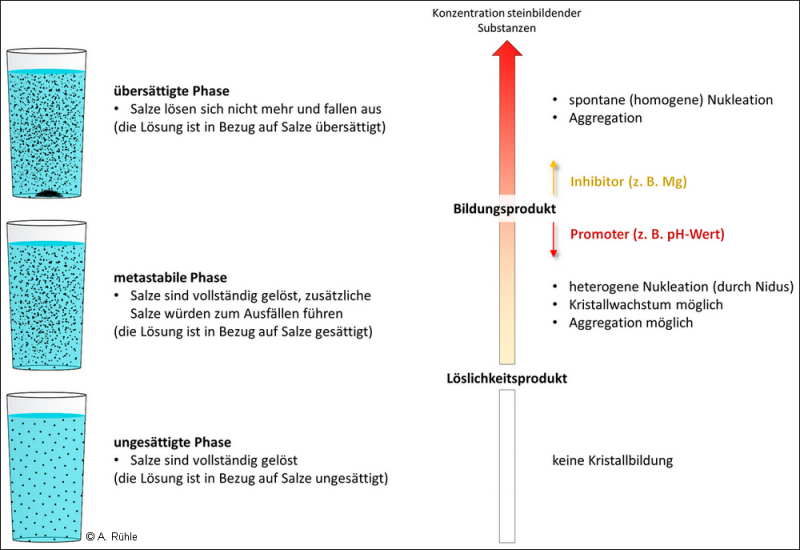 Abb. 3: Konzentration steinbildender Substanzen in verschieden gesättigten Lösungen, Kristallisation und Steinbildung
Abb. 3: Konzentration steinbildender Substanzen in verschieden gesättigten Lösungen, Kristallisation und Steinbildung
In Abbildung 3 ist das Prinzip verschiedener Sättigungsgrade einer Lösung mit Salzen (links) und deren Auswirkung auf die Harnsteinbildung (rechts) dargestellt. Während das Löslichkeitsprodukt ein fester Wert ist, der sich aus den beteiligten Ionen ergibt, stellt das Bildungsprodukt einen Bereich dar, der durch verschiedene Faktoren beeinflusst wird. Mit steigender Konzentration steinbildender Substanzen bis zur Übersättigung steigt auch das Risiko der Bildung von Harnsteinen. Durch Inhibitoren kann das Bildungsprodukt erhöht und somit die Steinbildung verringert werden. Selbst bei einer Übersättigung müssen also nicht zwingend Harnsteine entstehen (Pfau, 2016). Promoter senken dagegen das Bildungsprodukt und begünstigen somit die Bildung von Harnsteinen.
Die Nukleation wird unterschieden zwischen einer homogenen (spontanen) und einer heterogenen. Homogene Nukleation bedeutet die spontane Bildung eines Nidus (Kern eines Konkrements) in einer übersättigten Lösung in Abwesenheit anderer Substanzen. Der Nidus besteht in diesem Fall aus identischen Kristallen. Von heterogener Nukleation ist die Rede, wenn sich Kristalle an einer anderen Substanz anlagern und somit der Nidus entsteht. Diese Form der Nukleation kann bereits in der metastabilen Phase einer Lösung stattfinden. Ein Nidus kann sowohl aus anorganischen (Mineralien) wie auch aus organischen Substanzen bestehen. Kalzifikationen, die z. B. an geschädigten Epithelzellen der Nierenpapille verankert sind (nach ihrem Erstbeschreiber „Randall‘s“-Plaque genannt), können den Kristallisationskern für Harnsteine bilden. Die Pathogenese der Plaque an sich beinhaltet das Zusammenspiel mehrerer Faktoren, darunter Genpolymorphismus (Auftreten mehrerer Genvarianten innerhalb einer Population), oxidativer Stress, Entzündungsmediatoren, Matrixproteine und Übersättigung der Harnwege. Abbildung 4 zeigt eine schematische Darstellung der Harnsteinbildung im Organismus am Beispiel der „Randall’s Plaque“.4)5)
Zusammensetzung von Harnsteinen beim Kaninchen
An den Harnsteinen, die beim Kaninchen vorkommen können, sind hauptsächlich Calcium und Phosphor, seltener Magnesium, Oxalate und Proteine beteiligt. Die folgende Tabelle zeigt eine Übersicht einiger steinbildender Minerale der Harnsteine.6)
| Chemische Bezeichnung | Mineralogische Bezeichnung | Formel |
|---|---|---|
| Calciumcarbonat | Calcit | CaCO3 |
| Calciumcarbonat | Aragonit | CaCO3 |
| Calciumcarbonat | Vaterit | CaCO3 |
| Calciumoxalat-Dihydrat | Weddellit | Ca(COO)2 · 2H2O |
| Calciumoxalat-Monohydrat | Whewellit | Ca(COO)2 · H2O |
| Basisches Calciumphosphat | Hydroxylapatit | Ca10(PO4)6(OH)2 |
| Basisches Calciumphosphat | Carbonatapatit | Ca10(PO4CO3OH)6(OH)2 |
| Calciumhydrophosphat-Dihydrat | Brushit | CaHPO4 · 2H2O |
| Calciumorthophosphat | Whitlockit | Ca3(PO4)2 |
| Magnesiumammoniumphosphathexahydrat (Tripelphosphat) | Struvit | MgNH4PO4 · 6H2O |
| Dreibasisches Magnesiumphosphat-Octahydrat | Bobierrit | Mg3(PO4)2 · 8H2O |
Die folgende Tabelle enthält eine Aufstellung der Zusammensetzung von Harnsteinen bei Kaninchen (n=35).7)
| Zusammensetzung der Harnsteine | Anteil in % |
|---|---|
| monomineralisch | |
| Calcit | 8,57 |
| Carbonatapatit | 2,86 |
| mischmineralisch, 2 Komponenten | |
| Calcit/amorphes Calciumphosphat | 51,43 |
| Calcit/Carbonatapatit | 11,43 |
| amorphes Calciumphosphat/Calcit | 8,57 |
| Calcit/Weddellit | 2,86 |
| Calcit/Struvit | 2,86 |
| mischmineralisch, 3 Komponenten | |
| Calcit/Wheddellit/amorphes Calciumphosphat | 2,86 |
| Calcit/Carbonatapatit/amorphes Calciumphosphat | 2,86 |
| Carbonatapatit/Calcit/Wheddellit | 2,86 |
| Carbonatapatit/Wheddellit/Whewellit | 2,86 |
In den meisten Fällen der Harnsteine lagen Verbindungen aus Calcium und Phosphor vor, was die Wichtigkeit der beiden Mineralien in der Nahrung des Kaninchens unterstreicht - auch in Bezug auf Kiefer- und Zahnerkrankungen (Phosphor ist ein sogenannter „Calciumräuber“).
Ausgewählte Faktoren der Urolithiasis beim Kaninchen
Übersättigung der Lösung (Urin)
In Abbildung 3 sind verschiedene Phasen der Sättigung einer Lösung dargestellt. Diese sind abhängig von der Menge des Lösungsmittels (Urin) und der Menge der Salze, die es enthält. Das heißt, die Konzentration der verschiedenen Substanzen in einer Lösung spielt eine wichtige Rolle.
 Abb. 5: WasserAuch Kaninchen in einer Freilandhaltung mit ständigem Zugang zu natürlichen, frischen, wasserhaltigen Pflanzen nehmen noch zusätzlich Wasser auf, wenn es zur Verfügung steht.
Abb. 5: WasserAuch Kaninchen in einer Freilandhaltung mit ständigem Zugang zu natürlichen, frischen, wasserhaltigen Pflanzen nehmen noch zusätzlich Wasser auf, wenn es zur Verfügung steht.
In einer Dissertation8) wurde das Thema „Wachstum und Zahnabrieb“ bei Kaninchen studiert - als „Nebenprodukt“ standen Werte der Flüssigkeitsaufnahme zur Verfügung, die sich aus der zusätzlichen Verfütterung von Weißkohl, Grünkohl und Blumenkohlblätter ergaben. Alle Tiere nahmen täglich Trinkwasser in einem Verhältnis Wasser:Futtertrockensubstanz von ca. 2:1 auf, mit der Aufnahme von „Grünfutter“ betrug das Verhältnis durch den hohen Wassergehalt des Futtermittels entsprechend 5,5:1. Die hohe Wasseraufnahme bei Angebot des „Grünfutters“ führte auch zu deutlich größeren Harnvolumina (4-5mal höher als in den anderen Gruppen). Die Abhängigkeit der Konzentration von Calcium im Urin von der insgesamt aufgenommenen Wassermenge über Tränke und Nahrung zeigt das Abbildung 6 mit Werten aus der Arbeit von Bucher, 19949)
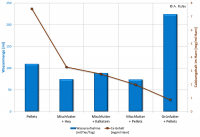 Abb. 6: Gesamtaufnahme von Wasser (Tränke + Nahrung) und Calciumgehalt im HarnEntsprechend der aufgenommenen Wassermenge und abhängig von dem Calciumgehalt im Futter nahm die Konzentration von Calcium im Urin von 0,87 mg Ca/ml Harn auf 7,57 mg Ca/ml Harn zu – das ist ungefähr das Neunfache.
Abb. 6: Gesamtaufnahme von Wasser (Tränke + Nahrung) und Calciumgehalt im HarnEntsprechend der aufgenommenen Wassermenge und abhängig von dem Calciumgehalt im Futter nahm die Konzentration von Calcium im Urin von 0,87 mg Ca/ml Harn auf 7,57 mg Ca/ml Harn zu – das ist ungefähr das Neunfache.
pH-Wert des Urins
Der Mensch ist ein „Allesfresser“ und beeinflusst verschiedene Stoffwechselvorgänge durch die Auswahl der Nahrung aus einem sehr großen Spektrum. Darauf ist, evolutionär bedingt, sein Organismus eingestellt. Der Stoffwechsel des Kaninchens als „Pflanzenfresser“ unterscheidet sich dagegen, ebenfalls evolutionär bedingt, in mancherlei Hinsicht. So resultiert aus der rein pflanzlichen Nahrung mit einem hohen Mineraliengehalt ein basischer Urin-pH-Wert von 8,010). Von Ewringmann, 201011) wird für diesen Wert ein Bereich von 8,0-9,0 angegeben. Für den Menschen liegt der Bereich des pH-Wertes des Urins nach verschiedenen Quellen zwischen 5,0-7,0.
Die Kombination aus einer übersättigten Lösung mit einem hohen (basischen) pH-Wert des Urins begünstigt das Ausfällen steinbildender Salze (chemische Verbindungen aus Ionen in kristalliner Form).
Sättigungsgrenzen steinbildender Salze bei unterschiedlichem pH-Wert; nach Brühl, 1989
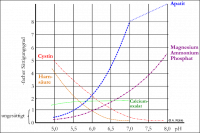 Abb. 7: Sättigungsgrenzen
Abb. 7: Sättigungsgrenzen
Mineraliengehalt und -verhältnis
Kaninchen selektieren ihre Nahrung nicht nach dem Calciumgehalt, sondern nehmen es in der Menge auf, wie es die Pflanzen enthalten. Das gilt aber nicht nur für Calcium, sondern für alle weiteren Substanzen ebenso wie z. B. Phosphor und Magnesium. Überschüssiges Calcium wird vom Kaninchen, anders als beim Menschen, überwiegend über die Niere mit dem Urin ausgeschieden. Die Evolution hat also der Tierart „Oryctolagus cuniculus“ eine Strategie zum Umgang mit einer sehr calciumreichen Nahrung mitgegeben. Das Kaninchen ist dabei gegenüber hohen Calziumgehalten und normalem Phosphorgehalt im Futter toleranter als umgekehrt12).
Ein Wildkaninchen frisst Breitwegerich mit einem Calciumgehalt von ca. 22,2 g/kg Trockensubstanz, der vergleichbar mit dem von Möhrenkraut ist (21,5 g/kg TS)
 Abb. 8: Wildkaninchen frisst Breitwegerich (Plantago major)
Abb. 8: Wildkaninchen frisst Breitwegerich (Plantago major)
Wildkaninchen oder Hauskaninchen, die arttypisch ernährt werden, tolerieren einen sehr hohen Calciumgehalt in ihrer natürlichen Nahrung ohne gesundheitliche Beeinträchtigungen. Das heißt, trotz eines sehr engen Korridors der Parameter für eine mögliche Harnsteinbildung, sind für solche Tiere keine Probleme bekannt. Für die Harnsteine von Herbivoren bestehen vergleichbare Verhältnisse hinsichtlich physikalisch-chemischer Parameter (Temperatur, pH, Mg/Ca- Verhältnis, Ionenstärke) der ausfällenden Lösung13). Es stellt sich also die Frage, warum Kaninchen nicht grundlegend häufiger Harnsteine entwickeln, sondern vor allem Tiere, deren Haltung und Ernährung mehr oder weniger stark von der der Wildform abweicht.
In ihrer Dissertation stellte B. Burger 200914) fest: „Das wesentliche Versuchsziel konnte in dieser Studie nicht erreicht werden – auch bei einer Fütterung mit hohem Kalziumgehalt – reinem Luzerneheu – konnte innerhalb von 20 Wochen bei 40 Kaninchen keine Urolithiasis ausgelöst werden.“. Der Calciumgehalt des Luzerneheus betrug 23,2 g/kg Futter (Pellets). Dagegen wurden von Ritskes-Hoitinga et al., 200415) bei einem Calciumgehalt von nur 4,5 g/kg Futter (Pellets) Verkalkungen der Nieren festgestellt, die mit steigendem Phosphorgehalt zunahmen. Die Versuchsdauer betrug 56 Tage (14 Wochen). Beide Versuche wurden mit jungen, wachsenden Kaninchen durchgeführt.
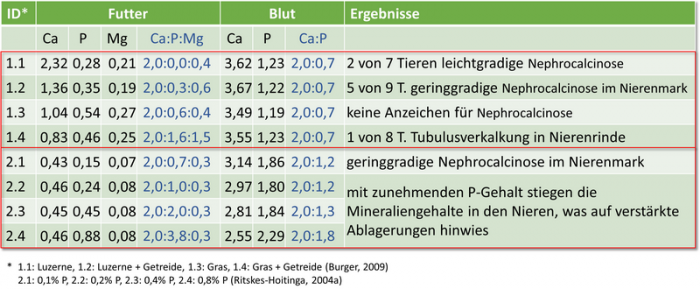 Abb. 9: Vergleich von Werten für Mineralien und ihrem Verhältnis zueinander (Basis Ca = 2,0) in Futtermitteln (in %) und im Blutplasma (in mmol/l), 1. aus Burger, 2009, 2. aus Ritskes-Hoitinga et al., 2004
Abb. 9: Vergleich von Werten für Mineralien und ihrem Verhältnis zueinander (Basis Ca = 2,0) in Futtermitteln (in %) und im Blutplasma (in mmol/l), 1. aus Burger, 2009, 2. aus Ritskes-Hoitinga et al., 2004
Die Ergebnisse von Burger, 2009 sprechen für sich: in diesem Versuch mit Trockenfuttern scheint bei einem Ca-Gehalt von 10,4 g/kg Futter sowie einem Phosphorgehalt von 5,4 g/kg kein Risiko für Nephrocalcinose bzw. Urolithiasis zu bestehen.
Die Ergebnisse von Ritskes-Hoitinga, 2004 wiesen einen Anstieg des Mineraliengehaltes der Niere mit zunehmendem P-Gehalt der Nahrung nach, was auf das Vorhandensein von Verkalkungen hinwies. Histologische Analysen bestätigten, dass mit zunehmenden P-Gehalt die Nephrocalcinose in Nierenrinde und -mark zunahm. Die Knochendichte der Femurdiaphyse verringerte sich mit einem steigendem P-Gehalt von 0,8% signifikant gegenüber der 0,2%-P-Gruppe. Der Knochen-Mg-Gehalt wurde bei der 0,8%-P-Diät sowohl in der Diaphyse als auch in der Epiphyse signifikant erhöht. Die Plasma-P-Konzentration stieg und der Ca-Gehalt sank mit höheren diätetischen P-Spiegeln, während der Plasma-Mg-Spiegel unbeeinflusst blieben. Als Ergebnis empfahlen die Autoren, die Empfehlung des NRC, 197716) mit einem minimalen Wert von 0,2% für den Phosphorgehalt im Futter eher als Maximum zu sehen, wobei die Bioverfügbarkeit des zugesetzten Phosphors zu beachten sei: „As the minimum P requirement of 0·2% (National Research Council, 1977) coincides with kidney calcifications in the cortex and medulla, it is advised that this P level should be regarded as a maximum level instead. Depending on the form of phosphate used, bioavailability could be different and therefore caution is warranted in using dietary P levels of 0,1 and 0,2%.“. Bei dieser Empfehlung ist aber zu beachten, dass sie sich auf einen relativ niedrigen Ca-Gehalt von 0,43% bezieht. So würde z. B. aus einer Verdopplung des Ca-Gehaltes auch ein doppelter P-Wert folgen, um das Verhältnis zu wahren.
In der zweiten Ausgabe von „Nutrition of the Rabbit“ gingen Mateos et al., 201017) auch auf die Empfehlung von Ritskes-Hoitinga unter dem Gesichtspunkt der Nierenverkalkung ein und folgerten, dass das Erreichen eines niedrigen Phosphorgehalt in kommerziellen Futtermitteln nur zu erreichen wäre, wenn der Einsatz einiger phosphorreicher Rohstoffe wie Getreide und Getreide-Nebenprodukten in Futtermitteln eingeschränkt werde. Allerdings wurde festgehalten, dass das eine Alternative wäre, die wirtschaftlich nicht vertretbar sei. So lautete denn auch eine Empfehlung dieser Autoren für Tiere, die älter als 2 Monate sind („finishing rabbits“) für den Gehalt von Ca=4,0 g/kg und für P=3,0 g/kg Futtermittel und eine Empfehlung für einen akzeptablen, kommerziellen Bereich („acceptable commercial range“) für Ca=3,0-6,0 g/kg und für P=3,0-4,5 g/kg Futtermittel.
In einer weiteren Arbeit von Ritskes-Hoitinga, 200418) wurde über 4 Jahre die Inzidenz von Kaninchen für Nierenverkalkungen untersucht. Zum Einsatz kamen Futtermittel mit einem Calciumgehalt von 0,9% und 1,1% sowie einem vergleichbaren Phosphorgehalt von 0,6% (Quotient Ca/P = 1,8-1,5). Die jährliche Inzidenz der Anzahl von Tieren mit Nierenverkalkungen im Cortex und/oder im Mark lag im Vergleich zur Gesamtzahl der Kaninchen entsprechend zwischen 16 % und 63 %.
Die Arbeiten von Ritskes-Hoitinga zeigten auch indirekt ein Problem, welches im Zusammenhang mit dem Verhältnis von Ca:P besteht – mit steigendem Phosphorgehalt bei konstantem Calciumgehalt hält der Körper Calcium zurück und erhöht die Ausscheidung von Phosphor, um das steigende Ungleichgewicht zwischen Ca und P auszugleichen. Außerdem wird Calcium aus dem Knochen gelöst, um den Überschuss von Phosphor zu kompensieren, weil sonst unlösliches Calciumphosphat ausfallen würde. Dieser Mechanismus wird über das Parathormon gesteuert. Außerdem wird in der Niere vermehrt Calcitriol synthetisiert, um das Phosphor zu resorbieren oder den Überschuss auszuscheiden. In diesem Fall könnte ein klarer Urin auch darauf hinweisen, dass Phosphor im Überschuss vorliegt und deshalb die Ausscheidung von Calcium verringert ist – weil es zurückgehalten wird, um ein Ungleichgewicht zu Phosphor auszugleichen.
In einem Artikel von Clauss et al, 201219) wurde noch einmal auf die Ergebnisse der Arbeit von Burger, 2009 zurückgegriffen und darauf hingewiesen, dass zusätzliche Faktoren als nur ein hoher diätetischer und damit hoher Ca-Wert im Urin erforderlich sind, um Urolithiasis auszulösen.
Da sich Empfehlungen zum Phosphorgehalt nicht unbedingt an der Gesundheit des Kaninchens orientieren, sondern eher wirtschaftlichen Interessen folgen, ist also ein Blick auf die Mineralienzusammensetzung in der natürlichen Nahrung des Kaninchens sowie auf die in Futtermitteln hilfreich, welche alternativ angeboten werden.
In Abbildung 10 sind Gehalte von Ca, P und Mg in verschiedenen Futtermitteln dargestellt. Mit dem Begriff „Extensivweide“ wird in dem Diagramm eine Grünlandfläche mit wenig Viehbesatz und ohne Düngung beschrieben, also ohne zusätzlichen Mineralieneintrag in den Boden. Der Wert für „Gemüse“ wurde aus den Gehalten von Paprika, Futterrübe, Karotte, Zucchini, Kopfsalat, Knollensellerie, Chicorée, Brokkoli und Kohlrabi gemittelt. Die Werte für „ID 1.1“ stammen aus der Dissertation von Burger, 2009 für den Fall, in dem keine Nephrocalcinose konstatiert wurde. Rechts neben dem Diagramm wird das Verhältnis der Mineralien zueinander mit der Basis von Ca = 2,0 aufgeführt sowie der Quotient aus Ca/P.
Mineraliengehalte in g/kg TS in verschiedenen Futtermitteln für Kaninchen sowie deren Verhältnisse zueinander
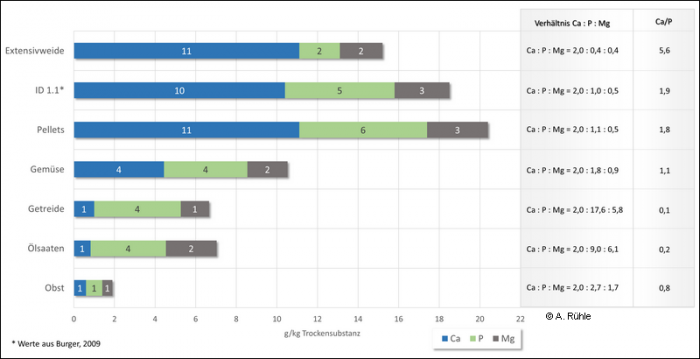 Abb. 10: Vergleich von Werten für Mineralien und ihrem Verhältnis zueinander (Basis Ca = 2,0) in Futtermitteln (in %) und im Blutplasma (in mmol/l), 1. aus Burger, 2009, 2. aus Ritskes-Hoitinga et al., 2004
Abb. 10: Vergleich von Werten für Mineralien und ihrem Verhältnis zueinander (Basis Ca = 2,0) in Futtermitteln (in %) und im Blutplasma (in mmol/l), 1. aus Burger, 2009, 2. aus Ritskes-Hoitinga et al., 2004
Prinzipiell lassen sich folgende Aussagen zu dem Diagramm in Abbildung 10 treffen:
- der Calciumgehalt in Grünpflanzen (Extensivweide) und in Pellets (ID 1.1 aus Burger, 2009 ohne Verkalkungen und handelsüblichem, kommerziellen Futter) liegt bei > 10 g/kg Trockensubstanz, während alle Alternativen weniger als die Hälfte davon enthalten,
- der Phosphorgehalt in Grünpflanzen beträgt ca. 2 g/kg TS und ist in allen anderen Futtermittel um das Doppelte und mehr höher,
- der Magnesiumgehalt der aufgeführten Futtermittel ist, außer in Getreide und Obst, vergleichbar.
Die folgende Abbildung 11 zeigt beispielhaft die Zusammensetzung der Nahrung von Wildkaninchen in Mitteleuropa im Winter (Dezember-März) und von Frühling bis Herbst (April-November). In jedem Fall besteht sie überwiegend aus Gräsern und Kräutern, die sehr calciumhaltig, aber verhältnismäßig arm an Phosphor sind.
Zusammensetzung der Nahrung von Wildkaninchen in Mitteleuropa, nach Werten aus Homolka, 198520) und Homolka, 198821)
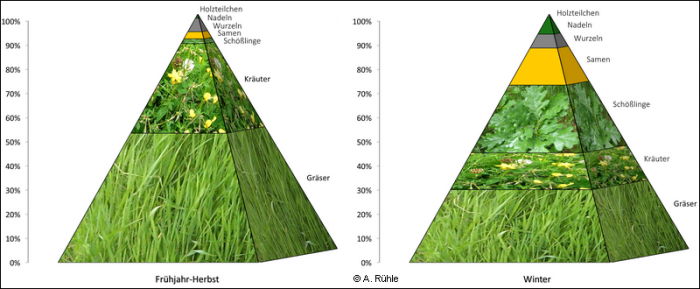 Abb. 11: Zusammensetzung der Nahrung von Wildkaninchen in Mitteleuropa, nach Werten aus Homolka, 1985 und 1988
Abb. 11: Zusammensetzung der Nahrung von Wildkaninchen in Mitteleuropa, nach Werten aus Homolka, 1985 und 1988
Im Humanbereich hat man erkannt, dass bei Nierensteinen ein Verzicht auf Calcium deren Entstehung sogar fördern kann. So wird bei Nierensteinen dazu geraten, die normale, empfohlene Menge von Calcium für Gesunde aufzunehmen – also die Calciummenge in der Nahrung nicht einzuschränken.22)23) Besonders die Studie von Ritskes-Hoitinga et al., 2004a zeigt eindrucksvoll auch für Kaninchen, dass selbst mit sehr niedrigen Calciumgehalten im Futter Verkalkungen in der Niere festgestellt werden können. Es ist offensichtlich: für Harnsteine ist nicht Calcium ursächlich, sondern andere Faktoren wie z. B. ein hoher Phosphorgehalt.
Vitamin D
Vitamin D ist sowohl ein Vitamin als auch ein Hormon. Es hat eine Reihe von physiologischen Wirkungen, die über seine Rolle im Calciumstoffwechsel hinausgehen. Aus funktionaler Sicht besteht die Hauptaufgabe von Vitamin D darin, die Kalzium- und Phosphorabsorption und -ausscheidung zu regulieren und die Mineralisierung von Knochen und Zähnen sicherzustellen. Empfehlungen für eine Supplementierung in Futtermitteln liegen zwischen 500-750 IE/kg Futter24)25). Die übliche Dosierung in Trockenfuttern beträgt heute ca. 1.000 IE/kg Futter. Der bereits vorhandene Anteil von Vitamin D durch den Einsatz natürlicher Ausgangsstoffe bleibt dabei aber unberücksichtigt. Das heißt, dass trotz Deklaration der Zugabe von Vitamin D der wahre Gehalt im Futter unbekannt ist. In der folgenden Tabelle ist beispielhaft die Zunahme des Vitamin-D-Gehaltes in verschiedenen Pflanzen dargestellt, deren erster Schnitt in verschiedenen Monaten des Jahres erfolgte26).
| Monat | Weißklee | Rotklee | Timothy |
|---|---|---|---|
| Juni | 60 | 31 | 40 |
| August | 679 | 750 | 571 |
| September | 1.800 | 1.400 | 1.100 |
Allgemein bekannt ist auch die Tatsache, dass vor allem sonnengetrocknetes Heu nicht unerhebliche Mengen an Vitamin D aufweist. Da in der Regel die pflanzliche Zusammensetzung des Heus nicht bekannt ist, ist entsprechend eine Abschätzung des Gehaltes an Vitamin D nicht möglich.
Inhibitoren
Als klassische Hemmer (Inhibitoren) für die Harnsteinbildung gelten ein hoher Flüssigkeitsgehalt, der einer Übersättigung des Urins mit Mineralien entgegenwirkt, Magnesium auf Grund der komplexbildenden Wirkung (bindet überschüssiges Calcium, sodass kein Calciumphosphat ausfallen kann) und Citrate. Weiterhin existieren sogenannte Urinproteine, die das Ausfällen unlöslicher Salze verhindern. Diese Faktoren sind nur über die Ernährung beeinflussbar.
Indirekt kann Salz in Form von NaCl einen Beitrag zur Verhinderung von Harnsteinen leisten, indem es die Harnmenge steigert und das spezifische Gewicht des Harns senkt27). Insofern ist die Bereitstellung eines Salzlecksteins (nicht zu verwechseln mit einem „Kalkstein“!) zur freien Verfügung durchaus überlegenswert. Wird allerdings eine exzessive, also übermäßige Nutzung festgestellt, sollte darauf verzichtet werden. Trotzdem sollte die Ursache für das Verhalten gefunden werden (Nährstoffmangel, Langeweile usw.).
Körperliche Aktivität, Adipositas
Die Übersättigung von Körperflüssigkeiten kann zu Sedimenten, also Ablagerungen ungelöster Salze in Gefäßen und Organen führen. Durch körperliche Aktivitäten werden diese immer wieder in Bewegung gebracht, also „aufgewirbelt“, was einer Steinbildung vorbeugt. Mit abnehmender Aktivität, was vor allem bei kastrierten, übergewichtigen Tieren oder solchen in Käfig-/Stall-/Wohnungshaltung gegeben sein kann, nimmt die Gefahr einer Nukleation oder Aggregation von Kristallen zu.
Prophylaxe
Für die Vermeidung von Harnsteinen existieren verschiedene Empfehlungen. Die häufigste ist die einer mögliche Meidung calciumreicher Futtermittel. Für Ewringmann, 201028) zählen z. B. „Kohlrabiblätter, Kräuter, Broccoli, Luzerneprodukte wie Luzerneheu und „Grünrollis““ dazu. Stattdessen sollten vermehrt Futtermittel mit einem hohen Flüssigkeitsgehalt wie „Salate, Tomate, Gurke“ gefüttert werden. In der folgenden Abbildung 12 sind die Ca- und P-Gehalte dieser Futtermittel aufgeführt, außerdem das Verhältnis von Ca:P (Basis Ca=2,0) sowie der Quotient aus Ca/P. Letzterer sollte nicht kleiner als 2,5 sein. Für die Kräuter wurde jeweils der Mittelwert aus Daten für Breitwegerich, Kresse, Löwenzahn und Petersilie gebildet und für Salate der Mittelwert für Kopfsalat, Romanosalat und Feldsalat.
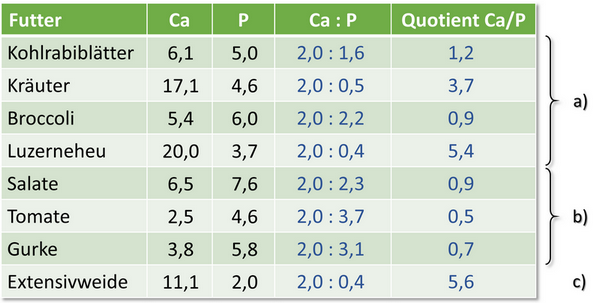 Abb. 12: Ca- und P-Gehalte in Futtermitteln, von denen abgeraten a) oder die empfohlen werden b). Zum Vergleich als Beispiel die natürliche Nahrung in Form der "Extensivweide" ohne Düngung (c)
Abb. 12: Ca- und P-Gehalte in Futtermitteln, von denen abgeraten a) oder die empfohlen werden b). Zum Vergleich als Beispiel die natürliche Nahrung in Form der "Extensivweide" ohne Düngung (c)
Gerade bei den empfohlenen Gemüsesorten ist das Ca/P-Verhältnis eher geeignet, Calciumphosphat ausfallen zu lassen. Abgesehen davon, sind solche Futtermittel (Salate, Gurke, Tomate) für den Zahnabrieb gänzlich ungeeignet und der Anteil an leicht verdaulichen Kohlenhydraten sehr hoch. Daraus folgen nicht selten Zahnfehler und Verdauungsstörungen.
Die Einseitigkeit der Betrachtungen zur Vermeidung von Harnsteinen kann dazu führen, dass andere, wichtige Faktoren unbeachtet bleiben. Als Beispiel sei die schwefelhaltige, essentielle Aminosäure „Methionin“ angeführt, die auch einen gewissen Beitrag zur Verhinderung von Ablagerungen in der Niere liefern kann. Sie säuert u. a. auch den Harn an, weil sie in der Niere zu Sulfaten (SO42-, HSO4-) und Protonen metabolisiert wird29). Paulus wies 2010 in ihrer Dissertation30) für eine Versuchsanordnung eine Ansäuerung des Harns durch eine Zugabe von Methionin nach: das Angebot eines Mischfutters mit höherem Proteingehalt und einer Methionin-Zulage hatte einen leichten Effekt auf den Harn-pH-Wert (Ø pH 8,61). Dieser unterschied sich signifikant von den Werten, die nach ausschließlicher Kraftfuttergabe gemessen wurden. In Gemüse und Salaten ist der Gehalt im Vergleich zu Wiesenpflanzen sehr gering und erreicht auch nicht empfohlene Werte von ca. 5 g/kg Trockensubstanz für Methionin und Cystin. Wenn ausreichend Cystin in der Nahrung vorliegt, kann daraus Methionin synthetisiert werden. Das heißt, neben einem möglichen, positiven Einfluss in Bezug auf die Bildung von Harnkonkrementen ist bei geringen Methionin- und Cystin-Gehalten außerdem die Verwertung des gesamten Proteins zweifelhaft31).
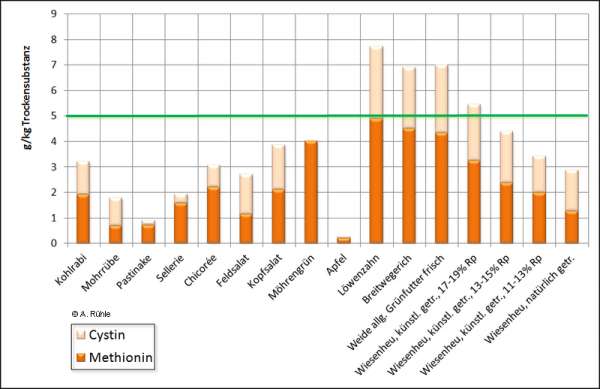 Abb. 13: Gehalte an Methionin und Cystin in g/kg Trockensubstanz in verschiedenen Futtermitteln, aus Rühle, 2017
Abb. 13: Gehalte an Methionin und Cystin in g/kg Trockensubstanz in verschiedenen Futtermitteln, aus Rühle, 2017
Zusammenfassung
Wichtige Faktoren, die einen Einfluss auf die Entstehung von Harnsteinen haben können:
- das „Lösungsmittel“ (Menge und pH-Wert des Urins),
- Mineralien (Salze in der Nahrung und deren Verhältnis zueinander),
- Wassergehalt der Nahrung,
- Inhibitoren (Hemmstoffe, die das Ausfallen von Salzen verhindern),
- Promoter (Stoffe, die ein Ausfällen von Salzen begünstigen)
- Vitamin D (Zugang zu UV-B-Strahlung),
- bakterielle Entzündungen (vor allem mit Beteiligung von E.-coli),
- Hyperparathyreoidismus (erhöhte Produktion von Parathormon),
- Körperliche (Nicht-)Aktivität,
- Kastration (durch den Wegfall hormoneller Einflüsse),
- Adipositas (starkes Übergewicht),
- Medikamente.
Ungefähre Gehalte für Calcium mit 10 g/kg, für Phosphor mit 2 g/kg und Magnesium ebenfalls mit 2 g/kg Trockensubstanz im Futter sind offensichtlich geeignet, die Entstehung von Harnsteinen beim Kaninchen zu verhindern und gleichzeitig für einen optimalen Knochenstoffwechsel sowie für die Neubildung von Zahnsubstanzen zu sorgen. Diese Gehalte entsprechen einem Verhältnis von Ca:P:Mg=2,0:0,4:0,4. In verschiedenen Publikationen wird ein Quotient für das Verhältnis von Ca/P angegeben, der in diesem Fall 5,6 betragen würde. Ein Wert von 2,5 sollte nicht unterschritten werden, um die Bildung unlöslicher Calciumphosphatverbindungen zu verhindern. Das gleiche gilt für Magnesium, welches komplexe Verbindungen mit Calcium bildet, die die dessen Bindungsfähigkeit mit anderen Salzen herabsetzt.
Die Empfehlung für eine Vitamin-D-Zulage von 500 IE/kg Trockensubstanz Futter wird als ausreichend erachtet, wobei ein Zugang der Tiere zu natürlichem Sonnenlicht eine bessere Form der Versorgung mit dem Vitamin/Hormon darstellt.
Ein Auslauf im Freien kann auch der Trägheit vorbeugen, die das Entstehen von Harnsteinen begünstigt, vor allem bei kastrierten Tieren.
Eine frische, arttypische Nahrung (Gräser und Kräuter von nicht gedüngten Grünflächen) sollte auf Grund des Wassergehaltes immer bevorzugt werden, weil sie im Vergleich zu Alternativen wie Gemüse weitere, wichtige Nährstoffe enthält.
Sogenannte Nager- oder Kalksteine sollten nicht angeboten werden, während ein reiner Salzleckstein kein Problem darstellen sollte – es sei denn, es wird ein exzessiver Gebrauch festgestellt.
Auf Pflanzen mit einem hohen Oxalsäuregehalt sollte prinzipiell verzichtet werden. Dazu gehören vor allem alternative Futtermittel wie Mangold, Spinat oder Portulak.
Auf keinen Fall sollten vergleichsweise calciumarme (Ca < 5g/kg TS) Futtermittel verabreicht werden, weil diese in der Regel mehr Risiken als Vorteile in sich bergen. Das heißt, bei Erkrankungen im Zusammenhang mit der Ernährung muss immer darauf geachtet werden, welche Faktoren beteiligt sein können und ob Alternativen wirklich eine Verbesserung erreichen können. Prinzipiell gilt, das hohe Phosphor- und/oder Oxalatgehalte auch einen hohen Calciumgehalt bedürfen, um das Ausfällen unlöslicher Verbindungen zu verhindern.
2 0 149