Inhaltsverzeichnis
Vitamin D
Metabolismus
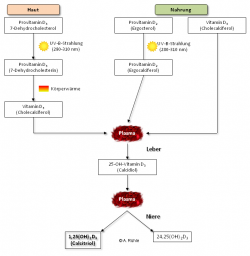 Abb. 1: Aufnahmewege und Metabolismus von Vitamin D„Vitamin D“ ist ein Oberbegriff für Secosteroide mit unterschiedlich biologisch aktiver Wirkung. Von Bedeutung sind:
Abb. 1: Aufnahmewege und Metabolismus von Vitamin D„Vitamin D“ ist ein Oberbegriff für Secosteroide mit unterschiedlich biologisch aktiver Wirkung. Von Bedeutung sind:
- Vitamin D3 (Cholecalciferol), Provitamine 7-Dehydrocholesterol und 7-Dehydrocholesterin,
- Vitamin D2 (Ergocalciferol), Provitamin Ergosterol
- Calcidiol (25-Hydroxycholecalciferol bzw. 25(OH)D3 oder 25(OH)D2) und
- Calcitriol (1,25-Dihydroxycholecalciferol bzw. 1,25(OH)2D3 oder 1,25(OH)2D2).
Als Kurzform für Calcitriol als die biologisch wirksamste Form wird oft nur „Vitamin D“ oder „Vitamin D3“ angegeben.
Prinzipiell entstehen D-Vitamine aus den Provitaminen Ergosterol oder 7-Dehydrocholesterin. UV-B-Strahlung führt bei mit Pilzen – die Ergosterol produzieren – besiedelten Pflanzen zum Ergocalciferol (Vitamin D2). Bei Tieren findet im ersten Schritt durch die UV-B-Strahlung in der Haut die Umwandlung zu 7-Dehydrocholesterin und im weiteren durch Körperwärme zu Cholecalciferol statt (Vitamin D3). Auch in verschiedenen Pflanzen wurde Vitamin D3 nachgewiesen.
Schließlich erfolgt der Metabolismus der Vorstufen in der Leber zur Bildung von Calcidiol (25(OH)D), welches schließlich in der Niere zu Calcitriol (1,25(OH)2D) umgewandelt wird. 1,25(OH)2D ist für die meisten, bekannten Wirkungen von Vitamin D verantwortlich.1) (Abbildung 1)
Wirkungen von Vitamin D
Die Serumkonzentration von 25(OH)D (Calcidiol) ist am besten für die Bestimmung des Gesamtvitamin-D-Status im Organismus geeignet, da sie aus diätetischem und sonnenlichtinduziertem Vitamin D besteht. Die Messung der Serum 1,25(OH)-Konzentrationen wiederum ist nützlich bei der Beurteilung von Störungen im Kalzium- und Knochenstoffwechsel im Zusammenhang mit erworbenen und angeborenen Fehlern bei der Umwandlung von Calcidiol in Calcitriol. Die Halbwertszeit von zirkulierendem Calcidiol beträgt 3 Wochen. Wenn sich ein Vitamin-D-Mangel entwickelt, reagiert der Körper, indem er die Produktion und Sekretion von Parathormon (PTH) erhöht, einem Hormon der Nebenschilddrüse. Dieses wiederum verstärkt die Hydroxylierung von Calcidiol. Ein sekundärer Hyperparathyreoidismus (vermehrte Bildung von Parathormon) verstärkt die Umwandlung von Calcidiol in Calcitriol. Da die zirkulierende Konzentration von Calcidiol etwa drei Größenordnungen höher als Calcitriol ist, können selbst sehr niedrige Werte von Calcidiol genügend Substrat für die Bildung von Calcitriol liefern. Bei Vitamin-D-Mangel wird Vitamin D auch effizient in Calcidiol umgewandelt. Infolgedessen kann ein Organismus mit Vitamin-D-Mangel, der zuvor eine sehr geringe Menge an Vitamin D aus der Nahrung oder der Sonneneinstrahlung erhalten hat, eine niedrige oder nicht nachweisbare zirkulierende Konzentration von Calcidiol aufweisen, während er eine niedrige, normale oder sogar hohe zirkulierende Konzentration von Calcitriol aufweist. Daher sind die Konzentrationen von Serum-Calcitriol bei der Beurteilung des Vitamin-D-Mangels von geringem Wert. Bei einem absoluten Vitamin-D-Mangelzustand ist zirkulierendes Calcitriol nicht nachweisbar2).
Calcium- und Knochenstoffwechsel
Eine Überproduktion von Calcitriol würde zu Hypercalcämie führen, die unzureichende Synthese dagegen zu verringerter Calciumabsorption im Darm, Hypocalcämie und Mineralisierungsstörungen im Skelett. Die verschiedenen Metaboliten verfügen auch über unterschiedliche Wirkungen, die zudem tierartspezifisch sind. So wurde von (Rambeck et al., 1990) für Kaninchen festgestellt, dass Calcitriol (1,25(OH)2D3) am leichtesten Verkalkungen auslöst, gefolgt von 1,25(OH)2D2, 1α(OH)D3 und 1α(OH)D2. Im Vergleich war 1,25(OH)2D3 ungefähr doppelt so kalzinogen wie 1α(OH)D3 und etwa viermal so kalzinogen wie 1α(OH)D2. Die Versuche wurden mit isolierten natürlichen und künstlichen Vitamin-D-Metaboliten durchgeführt.
Vitamin D sorgt für die Regulierung des Calcium- und Phosphor-Stoffwechsels und fördert deren Resorption aus dem Darm. Es steuert somit die Ca- und P-Umlagerung im Skelett und reguliert die Ca- und P-Ausscheidung über die Niere. Außerdem unterstützt es die Reifung von Immunzellen. Bekannt wurde das Vitamin im Zusammenhang mit „Rachitis“ (Knochenweiche), eine Erkrankung des wachsenden Knochens mit gestörter Mineralisation der Knochen und Desorganisation der Wachstumsfugen. Als Ursache fand sich neben einer gestörten Ca/P-Konzentration im Blut ein zu geringer Gehalt an Vitamin D. Deshalb erhielt es auch die Bezeichnung „antirachitisches“ Vitamin. Auf Grund der Kenntnis, dass rachitische Wirkungen durch Sonnenlicht beeinflussbar sind, erhielt es auch den Namen „Sonnenhormon“.
Der Einfluss von Vitamin D im Zusammenhang mit UV-Strahlen auf den Knochenstoffwechsel ist schon recht lange bekannt. Mellanby und Killick, 19263) untersuchten z. B. den Einfluss von UV-B-Strahlen als Teil des Sonnenlichts auf die Bildung von Vitamin D unter Zuhilfenahme von Quecksilberdampflampen an Kaninchen und Pflanzen. Nachdem Tiere dreimal in der Woche mit den Lampen bestrahlt wurden, wiesen diese im Vergleich zu den nicht bestrahlten eine normale Knochendichte auf, die nicht bestrahlten entwickelten Rachitis. Ebenso verhielt es sich mit dem Futter. Die Verfütterung von Kohl, der bestrahlt wurde, resultierte in annähernd normalen Zähnen und Knochen, während die Verfütterung von unbestrahltem zu Rachitis führte.
In ähnlichen Untersuchungen wurde von Hume et al., 19274) festgestellt, dass bereits die Bestrahlung kleiner Bereiche der Haut des Kaninchens (2,5 x 3,5 cm = 8,75 cm2, depiliert) ausreichte, den Bedarf an Vitamin D bei einer defizitären Ernährung auszugleichen. Die Bestrahlung wurde dreimal pro Woche für jeweils 10 Minuten durchgeführt.
(Gross-Selbeck, 1935) stellte bei Ratten eine Verhütung der Folgen einer Überdosierung von Vitamin D durch reichliche, aber ungiftige Vitamin-A-Dosen fest.
Eine Feststellung in der Dissertation von Allemann, 19425) lautete, dass das „antirachitische Vitamin“ seine Wirkung im Organismus erst dann entfalte, wenn im Futter bei ungünstigem Ca/P-Verhältnis ein gewisses Minimum an Calcium und Phosphor vorhanden ist, wobei es ein ungünstiges Ca/P-Verhältnis bis zu einem gewissen Grade ausgleichen konnte. In vergleichenden Untersuchungen von Bekemeier, 19596) bei gleicher UV-Bestrahlung wurde die Aktivität des Provitamin D in der Ratten-, Kaninchen- und Meerschweinchen-Haut zuerst erhöht und mit zunehmender Länge der Einwirkung verringert. Die maximale Aktivität betrug für Ratten 5-15, für Kaninchen 2-5 und für Meerschweinchen bis zu 3 IE/cm2.
Nach Mangold & Fangauf, 19507) ist das Bedürfnis nach Vitamin D besonders groß bei Kurzhaarkaninchen, bei denen die Rachitis in sekundärer Auswirkung der Kurzhaarfaktoren als „Rassenmerkmal“ auftritt, wenn sie keine erhöhte Zufuhr von phosphorsaurem Kalk und Vitamin D erhielten.
[Das Enzym LIPH wird u.a. in der Leber und in den Nieren exprimiert8), Anmerkung KH]
Von Dorn, 19739) wurde über die Verkalkung der Nierenkanälchen berichtet, wenn eine Überdosierung von Vitamin D vorlag. Ansonsten kämen Halter, die über „kalkspendende Pflanzen reichlich verfügen, ohne Mineralzufütterung vollständig aus“. Voraussetzung wäre aber, „dass die Ställe genügend Licht haben (Offenställe), denn der Tierkörper kann unter Einwirkung der ultravioletten Sonnenstrahlen seinen Kalkstoffwechsel weitgehend regulieren und dabei das Vitamin D bilden. Die ultravioletten Strahlen durchdringen nicht das Fensterglas, deshalb sollen bei Innenställen die Fenster und Türen offengehalten werden“.
Bourdeau et al., 198610) fanden bei Kaninchen mit einem chronischen Vitamin D-Mangel und einem Futter, welches 1% Ca und 0,5% P enthielt, eine leichte Hypokalzämie (verringerter Calciumspiegel im Blut), eine moderate Hypophosphatämie (verringerter Phosphatspiegel im Blut) und in der Regel erhöhte Serum-PTH-Konzentrationen. Die intestinale Resorption von Ca oder P war bei Tieren gleich, die mit Vitamin D chronisch unterversorgt waren oder das Vitamin als Supplement erhielten. Die Urinausscheidungsraten der beiden Mineralien waren dabei deutlich reduziert.
Brommage et al., 198811) bestätigten den prinzipiellen, hormonellen Mechanismus, der ähnlich dem anderer Spezies ist. Sie untersuchten auch den Einfluss von Vitamin D auf die Knochendichte von Kaninchen. Diese erhielten jeweils ein Futter ohne Vitamin D-Anreicherung und die Kontrolltiere mit Vitamin D über einen Zeitraum von 19,6 Monaten. Die Serumspiegel von 25-OH-D und 1,25-(OH)2D3 waren in allen Vitamin D-defizitären Kaninchen nicht nachweisbar, während sie in typischer Weise bei den Kontrollkaninchen vorhanden waren. Obwohl einige Vitamin D-defizitäre Kaninchen in der Lage waren, normale Serum-P-Spiegel aufrechtzuerhalten, fielen bei anderen Kaninchen die Serum-P-Spiegel drastisch. Die resultierende Hypophosphatämie bei diesen Kaninchen führte zu einer unzureichenden Skelettmineralisierung und den klassischen Anzeichen einer Osteomalazie (Knochenweiche auf Grund eines Vitamin-D- oder Calciummangels). Es wurde festgestellt, dass die passive, intestinale Absorption von Calcium sehr effizient ist und bei einem ausreichenden Calciumgehalt Vitamin D für die Skelettmineralisierung nicht erforderlich zu sein schien. Jedoch erhöhte Vitamin D die Darmabsorption von Calcium und wurde erforderlich, wenn der Calciumgehalt niedrig war. Weil es passiv absorbiert wird, gab es keinen Rückkopplungsmechanismus und das Calcium wurde bei höheren Mengen im Verhältnis zu der diätetischen Calciumkonzentration absorbiert. Zusammenfassend wurde festgestellt, dass die Ergebnisse die Bedeutung von Vitamin D bei der Aufrechterhaltung der normalen P-Absorption im Darm bei erwachsenen Kaninchen betonen. Die ermittelten Ergebnisse stimmten weitgehend mit denen von Bourdeau, et al., 1986 überein.
Die aufgeführten Ergebnisse zeigen, dass der direkte Einfluss von Vitamin D auf den Mineralisierungseffekt bei Kaninchen relativ gering, aber nicht „Null“ ist. Das Vitamin wird besonders wichtig, wenn die Gehalte von Calcium und Phosphor in der Nahrung niedrig sind oder deren Verhältnis zueinander von der Norm abweicht. Diese Einflüsse auf den Ca-/P-Stoffwechsel werden heute als die „klassische“ Funktion von Vitamin D bezeichnet.
Weitere
In den letzten Jahrzehnten wurden, zusätzlich zu einem möglichen Einfluss auf den Calcium- und Phosphorstoffwechsel, weitere Bedeutungen von Vitamin D erkannt. Das hing vor allem mit der Entdeckung der speziellen Wirkungen von Vitamin-D-Rezeptoren (VDR) zusammen. Dabei handelt es sich um Bindungsstellen in Zellen für die aktive Form des Vitamins 1,25(OH)2D3. Diese Bindungsstellen finden sich fast überall im Körper wie z. B. im Magen, Darm12), Gehirn, in der Hirnanhangsdrüse, der Haut, in Monozyten und in aktivierten T- und B-Lymphozyten. An diese Rezeptoren dockt die aktive Vitaminform Calcitriol an und löst verschiedene Reaktionen der Proteinbiosynthese aus. VDR wirken z. B. als Rezeptor für die sekundäre Gallensäure Lithocholsäure (LCA), die giftig für Leber und Darm ist. Die Aktivierung von VDR durch LCA oder die Vitamin-D-induzierte Expression von Enzymen führen zur Entgiftung der LCA in der Leber und dem Darm und können nach Untersuchungsergebnissen von Makishima et al., 200213) somit Darmkrebs verhindern. Von Froicu et al., 200314) wurde an Mäusen nachgewiesen, dass Calcitriol die Entwicklung von Autoimmunerkrankungen und entzündlichen Darmerkrankungen unterdrückt, wenn auch die genauen Mechanismen noch ungeklärt sind.
Li et al., 202515) untersuchen die Wirkung der Vitamin D-Supplementierung (700, 1.400, 2.100, 2.800 IU/kg Grundnahrung, pelletiert) auf die Entwicklung der Haarfollikel und den Fettstoffwechsel bei 3-Monate alten Rexkaninchen. Es wurden Unterschiede in der Länge und Feinheit der Fellhaare sowie der Dichte der (sekundären) Haarfollikel festgestellt. Weiters zeigten die Ergebnisse der Genexpressionsanalyse (2.100 IU/kg vs. Kontrollgruppe), dass Vitamin D sowohl die Entwicklung der Haarfollikel und den Haarzyklus – über verschiedene Faktoren und Signalwege wie Wnt/β-catenin, SHH, IGF1, Noch, EGF oder miR-205 – als auch den Fettstoffwechsel in Fett- und Lebergewebe, sowie der Skelettmuskulatur beeinflussen kann.
Kaninchen und Sonne
 Abb. 2: Wildkaninchen beim "Sonnenbaden"
Kaninchen werden in der Literatur häufig als „überwiegend dämmerungs- und nachtaktiv“ beschrieben. Daraus könnte man schließen, dass sie eigentlich nur sehr selten natürlichem Sonnenlicht ausgesetzt sind. In ihrer Dissertation zitiert Hansen, 201216) eine Aussage von Kamphues, 199917), nach der es diskussionswürdig wäre, „ob die unter natürlichen Bedingungen tagsüber in unterirdischen Höhlen lebende und im Wesentlichen nur nachts aktive Spezies überhaupt einen „üblichen Vitamin D-Bedarf“ hätte, da die notwendige UV-Strahlung zur Umwandlung des mit der pflanzlichen Nahrung aufgenommenen Vitamin D2 (Ergocalciferol) unter diesen Bedingungen ohnehin fehle.
Abb. 2: Wildkaninchen beim "Sonnenbaden"
Kaninchen werden in der Literatur häufig als „überwiegend dämmerungs- und nachtaktiv“ beschrieben. Daraus könnte man schließen, dass sie eigentlich nur sehr selten natürlichem Sonnenlicht ausgesetzt sind. In ihrer Dissertation zitiert Hansen, 201216) eine Aussage von Kamphues, 199917), nach der es diskussionswürdig wäre, „ob die unter natürlichen Bedingungen tagsüber in unterirdischen Höhlen lebende und im Wesentlichen nur nachts aktive Spezies überhaupt einen „üblichen Vitamin D-Bedarf“ hätte, da die notwendige UV-Strahlung zur Umwandlung des mit der pflanzlichen Nahrung aufgenommenen Vitamin D2 (Ergocalciferol) unter diesen Bedingungen ohnehin fehle.
 Abb. 3: Wildkaninchen beim "Sonnenbaden"
Zum einen widersprechen die vorangestellten Ergebnisse aus Literaturangaben dieser Annahme, zum anderen zeigen Beobachtungen verschiedener Gruppen von Wildkaninchen an verschiedenen Orten, dass diese auch tagsüber mehr oder weniger Zeit außerhalb des Baus verbringen.
Abb. 3: Wildkaninchen beim "Sonnenbaden"
Zum einen widersprechen die vorangestellten Ergebnisse aus Literaturangaben dieser Annahme, zum anderen zeigen Beobachtungen verschiedener Gruppen von Wildkaninchen an verschiedenen Orten, dass diese auch tagsüber mehr oder weniger Zeit außerhalb des Baus verbringen.
Viele Gruppenmitglieder sind vor Einbruch der Dämmerung aktiv und nutzen auch die frühen Morgenstunden zum Äsen oder für soziale Aktivitäten. Selbst an sehr heißen Tagen lassen sich viele Tiere beobachten, die auch am hellen Tag Zeit außerhalb des Baus verbringen, nur bei starkem Regen und Wind ziehen sie sich dorthin zurück. In der Regel beginnen ab 17:00 Uhr die Aktivitäten im Freien, sowohl im Sommer wie auch im Winter. Ähnliche Beobachtungen machten z. B. Stodart und Myers, 196418) in Australien und Selzer, 200019) in Deutschland in einem Vergleich von Wild- und Hauskaninchen, wobei die Wildkaninchen unter semi-natürlichen Bedingungen (Freigehege) gehalten wurden.
Vitamin D und Zahngesundheit
Zhang et al., 200920) stellten einen Einfluss von VDR auf Odontoblasten und Ameloblasten als Zielzellen für die Vitamin-D-Funktion fest, obwohl der Mechanismus dafür noch unklar blieb. Odontoblasten bilden lebenslang Dentin, während Ameloblasten für die Bildung von Zahnschmelz verantwortlich sind. Neuere Untersuchungen deuteten darauf hin, dass 1,25(OH)2D3 die VDR hochreguliert, was wiederum strukturelle Genprodukte induziert, darunter kalziumbindende Proteine und mehrere extrazelluläre Matrixproteine, die für die Dentinbildung wichtig sind. Während klar ist, dass die Dentin-Hypomineralisierung dem Trend der Hypokalzämie folgt, spielt der Calciumspiegel im Plasma eine große Rolle in der Dentinmineralisierung. Da die Schmelz-Hypermineralisierung unabhängig von der extrazellulären Hypokalzämie ist, wirkt ein Vitamin-D-Mangel vorwiegend lokal auf die Schmelzmineralisierung. Das heißt, dass es unabhängig vom Calcium-/Phosphorstoffwechsel Einflüsse von Vitamin D auf die Mineralisierung von Zähnen gibt.
Vorkommen in Pflanzen
Scheunert und Reschke, 193021) ermittelten für verschiedene Gräser, die am eigenen Institut gesammelt und untersucht wurden, Vitamin D-Gehalte und Nachweise für eine „rachitische“ Wirkung bei Ratten. Wiesenschwingel (Festuca pratensis) und weißes Straußgras (Agrostis stolonifera) erwiesen sich als am wenigsten, Deutsches Weidelgras (Lolium perenne), Französisches Raygras (Arrhenatherum elatius) und Timotheegras (Phleum pratense) als besser antirachitisch wirksam. Noch besser wirkten Rotschwingel (Festuca rubra spp.) und Rohrglanzgras (Phalaris arundinacea), am besten aber Knaulgras (Dactylis glomerata) und Wiesenrispe (Poa pratensis). Ein Vergleich mit gleichen Arten, die aus einer anderen Gegend stammten, bestätigten das Ergebnis nicht, allerdings war auch nichts über die Umstände (Bodenbeschaffenheit, Wetter, Sonneneinstrahlung etc.) für dieses Pflanzen bekannt.
Raoul et al., 196822) isolierten Vitamin D3 aus den Wurzeln und Blättern von frischem Knaulgras (Dactylis glomerata), was im Prinzip das Ergebnis von Scheunert & Reschke23) bestätigte.
Untersuchungen von Rambeck et al., 198124) ergaben, dass eine beträchtliche Menge an Cholecalciferol, dem „tierischen Vitamin D“, in Goldhafer (Trisetum flavescens) vorkommt. Verteilungsstudien zeigten hohe Konzentrationen in jungen, blattreichen Teilen und niedrige Konzentrationen in Stängeln, Blüten, Samen und Wurzeln. Fünf verschiedene Sorten von Goldhafer waren in der Vitamin-Aktivität ähnlich. Pflanzen, die unter völligem Ausschluss von UV-Strahlung angebaut wurden, hatten überhaupt keine Vitamin D-Aktivität, aber ein Extrakt aus ihnen, die ohne UV-Licht angebaut wurden, zeigte nach kurzer Exposition gegenüber UV-Strahlung volle Vitamin D-Aktivität. Diese Ergebnisse deuteten darauf hin, dass das „tierische Vitamin D“ Cholecalciferol nicht nur in einer höheren Pflanze vorkommt, sondern auch, wie in der Haut von Wirbeltieren, durch UV-Strahlung aus ihren Vorläufern in Pflanzen gebildet wird.
Von Horst et al., 198425) wurde Vitamin D2 und Vitamin D3 in Luzerne (Medicago sativa) nachgewiesen, die unter Feld- und Laborbedingungen angebaut und dann mit ultraviolettem Licht bestrahlt wurden. Sonnengetrocknete, im Freiland gezüchtete Luzerne enthielt Vitamin D2 in einer Konzentration von 48 ng/g (1920 IU/kg) und Vitamin D3 in einer Konzentration von 0,63 ng/g (25 IU/kg). Im Labor gezogene Luzerne, künstlich bestrahlt, enthielt Vitamin D2 in einer Konzentration von 80 ng/g und Vitamin D3 in einer Konzentration von 1,0 ng/g.
Von Kamphues et al., 198626) wurde festgestellt, dass Kaninchen, selbst in der Phase intensiven Wachstums, nur über einen geringen Vitamin D-Bedarf verfügen. Gehalte von 500 IE/kg in einem Alleinfutter wären bei adäquater Ca- und P-Zufuhr (5-8 bzw. 4-6 g/kg) ausreichend.
Die bekannteste Wiesenpflanze in Bezug auf einen Vitamin D3-Gehalt ist der Wiesen-Goldhafer (Trisetum flavescens), in dem 1,25-(OH) 2D3 an verschiedene Glukoside gebunden vorliegt. Das 1,25-(OH) 2D3-25-Glukosid entwickelt dabei eine mehr als halb so starke, kalzinogene Aktivität als die anderen Glukoside (Rambeck et al., 198727)). Vor allem in den Alpen bereitet der Goldhafer auf Grund seiner kalzinogenen Wirkung immer wieder Probleme für Rinder in Zusammenhang mit der Weidewirtschaft.
Tabelle 1: Vitamin-D-Gehalte in verschiedenen Futtermitteln, aus Meyer & Coenen, 200228)
| Futter | Vitamin D in IE/kg uS(1) | Vitamin D in IE/kg TS(2) |
|---|---|---|
| Grünfutter, Weide, jung | 30-50 | 150-250 |
| Grünfutter, älter | 50 | 250 |
| Grassilage, frisch | 50-70 | 167-389 |
| Heu, unterdachgetrocknet | 200 | 250 |
| Heu, gut, sonnengetrocknet | 500-1.000 | 625-1.250 |
| Klee- und Luzerneheu | 200 | 250 |
(1) ursprüngliche Substanz (Frischesubstanz)
(2) errechnet (Grünfutter = 20% TS, Silage = 18% TS, Heu = 80% TS)
Heu, welches an der Sonne vor- und später unter Dach fertig getrocknet wurde, enthielt Vitamin D3-Gehalte von 500-1000 IE/kg (Heu-Kaufen.com, 2016)29). Für Gemüse existiert kein Nachweis für einen Gehalt an Vitamin D, ebenso wenig für Salate oder Grünes vom Gemüse.
Die Trocknung von frischen Pflanzen an der Sonne bewirkt zwar einen Anstieg des Vitamin-D-Gehaltes, führt aber zu einem Verlust anderer Vitamine bzw. deren Vorstufen, so z. B. ß-Carotin und Vitamin E sowie essentieller Nährstoffe wie z. B. Fettsäuren.
25(OH)D-Serumkonzentration
Nach Harcourt-Brown, 200230) konnte bei Laborkaninchen, die ohne Zugang zu ultraviolettem Licht gehalten wurden und eine Vitamin-D-arme Nahrung erhielten, nach 5 Monaten im Serum kein 25-OH-D und 1,25-(OH)2D3 mehr nachgewiesen werden. Eine Untersuchung an Kaninchen, die in Freilandhaltung oder im Stall ohne Zugang zu Sonnenlicht gehalten wurden, zeigte einen ähnlichen Effekt.
Emerson et al., 201431) setzten 5 junge, pigmentierte Heimkaninchen in Innenhaltung täglich für jeweils 12 Stunden künstlicher UV-B-Strahlung aus (8.3–58.1 µW/cm2). Nach 14 Tagen wurde bei diesen Kaninchen eine im Vergleich zur Kontrollgruppe signifikant höhere Konzentration an Serum-25-Hydroxyvitamin Dx* gemessen: 66,4 ± 14,3 nmol/L vs. 31,7 ± 9,9 nmol/L. Die Kontrollgruppe bestand aus 4 Tieren, die unter denselben Bedingungen gehalten und ebenfalls mit Timothy-Heu ad libitum sowie supplementierten Pellets [VitD 900 IU/kg32)] gefüttert wurden, jedoch keiner zusätzlichen UV-B-Strahlung ausgesetzt waren. Die Autoren merkten an, dass die klinische Bedeutung des festgestellten Konzentrationsanstiegs noch unbekannt sei.
Das Ziel der Folgestudie von Molitor et al., 202333) war es, zu ermitteln, ob eine kürzere UV-B-Exposition (6 anstelle von 12 Stunden täglich, 15–50 µW/cm2) zu einem ähnlichen Anstieg der 25(OH)Dx*-Konzentrationen führen kann, während mögliche negative Auswirkungen einer künstlichen Bestrahlung, wie Photodermatose, Hautrötung, Schädigung der Augen oder Krebs, minimiert werden. Die Ergebnisse bestätigten die Annahme: 79,8 ± 13,6 nmol/ L vs. 27,7 ± 8,1 nmol/L (n = 6). „At this time, based on these results and the results of Watson et al.[34)], the authors recommend no more than 6 h of UVB exposure per day for pet rabbits.“
Basierend auf Human-Daten stuften Molitor et al. die unbehandelten Kontrollkaninchen35)[36)]37) als Vitamin D-defizitär ein.
Anmerkungen:
*: [Watson et al.38) und] Molitor et al.39) berichteten „25(OH)D3“-Konzentrationen, verwiesen für die Testmethode (Radioimmunoassay, RIA) allerdings auf Emerson et al.40), welche die Gesamtkonzentration von 25(OH)D angaben, siehe auch 41).
Es ist außerdem anzunehmen, dass in den vorangehend angeführten Untersuchungen42)[43)]44) auch das angebotene Heu der UV-B-Strahlung ausgesetzt war.
„Pet Rabbit Health Research Project“ in Finnland
Mäkitaipale et al., 201945) bestimmten mittels Enzyme Immunoassay (EIA) Gesamt-25(OH)D-Serumkonzentrationen bei 140 Heimkaninchen in Finnland (Stichprobe siehe auch Mäkitaipale et al., 201546), bzw. 47), S. 41) – die Ergebnisse variierten zwischen 5 [12,5] und 68 ng/mL [170 nmol/L]. Für finnische Heimkaninchen schien Vitamin D aus der Nahrung eine bedeutende Rolle zu spielen; allein (begrenzter) Zugang zum Freien konnte eine ausreichende Vitamin D-Versorgung nicht sicherstellen.
Die Ergebnisse von Mäkitaipale et al., 202048) (n = 139, EIA) deuteten darauf hin, dass, hinsichtlich der Knochengesundheit, eine PTH-bezogene 25(OH)D-Serumkonzentration von 17 ng/mL [42,5 nmol/L] als Schwellenwert für einen Vitamin D-Mangel bei Kaninchen angesehen werden kann.
Einen ähnlichen Schwellenwert von 19 ng/mL ermittelte J. Mäkitaipale in Bezug auf die Dichte der Schienbeinrinde (n = 87).[49)]50)
Mäkitaipale et al (2015-2020) konnten keinen Zusammenhang zwischen Serum-25(OH)D sowie Tibia-Knochenparametern und Zahnerkrankungen feststellen. (Das gewählte Studiendesign war ohnehin nicht geeignet, um diesbezügliche Kausalzusammenhänge zu identifizieren.)
Mäkitaipale et al., 202451) analysierten (mittels EIA) 64 Serumproben von Wildkaninchen, die in den Jahren 2013 und 2019-2021 in Finnland erjagt worden sind. Die mittlere 25(OH)D-Konzentration betrug nur 3,3 (0,3-7,1) ng/mL, wobei Jahreszeit, Monat oder Jahr der Beprobung, sowie das Geschlecht keinen wesentlichen Einfluss hatten. Vermutlich sei vor allem die Nahrung der Wildkaninchen für diesen anscheinend52) schweren Vitamin D-Mangel verantwortlich. Für zukünftige Tests und zur besseren Beurteilung der Herkunft des Vitamin D (Nahrung oder UV-B-Strahlung) empfahlen die Autoren eine getrennte Messung von 25(OH)D2 (aus Heu) und 25(OH)D3.
Mäkitaipale et al., 202453) gingen der Frage nach, ob künstliche UV-B-Bestrahlung (i) der Haut (direkt) oder (ii) des Futter-Heus (indirekt) einen stärkeren Einfluss auf die Bildung von Serum-25(OH)D bei Kaninchen hat und wählten die folgende Versuchsanordnung. 24 weibliche, adulte Weiße Neuseeländer wurden gleichmäßig in drei Gruppen eingeteilt:
- Kontrollgruppe „C“ – weder direkte noch indirekte UV-B-Bestrahlung;
- Gruppe „D“ – direkte Bestrahlung für 12 Stunden/Tag (7 – 69 μW/cm2), keine indirekte Bestrahlung (Futterplatz schattiert und Herausscharren des Heus verhindert);
- Gruppe „I“ – keine direkte Bestrahlung, jedoch indirekte Bestrahlung für 12 Stunden (vor dem Verfüttern, 21 – 73 μW/cm2).
Das verwendete Heu54) stammte aus einem zweiten Schnitt und bestand zu etwa 30 % aus Hülsenfrüchtlern. Es wurde künstlich in Innenräumen getrocknet und ohne direkte Sonneneinstrahlung gelagert. Die Vitamin D2-Gehalte waren 2.22 µg/100 g TS in nicht-bestrahltem und 6.06 µg/100 g TS in bestrahltem Heu. Weder in nicht-bestrahltem noch in bestrahltem Heu war Vitamin D3 nachweisbar.
Die getesteten Parameter waren: ionisiertes Calcium (iCa); Calcium (Ca), Magnesium (Mg), Phosphor (P); Serum 25(OH)D2 und 25(OH)D3 (mittels LC-MS/MS) – jeweils zu Beginn und wöchentlich über die Versuchsdauer von vier Wochen.
Alle Tiere blieben während des gesamten Versuchs klinisch gesund.
Die Aufnahme von UV-B-bestrahltem Heu hatte einen deutlich stärkeren Einfluss auf den Vitamin-D-Spiegel im Serum (Gesamt-25(OH)D und 25(OH)D2) als die direkte Bestrahlung. Vitamin D2 aus der Nahrung könnte demnach die Gesamtkonzentration von 25(OH)D wirksamer erhöhen als die endogene Vitamin D3-Synthese unter künstlicher Bestrahlung, und Kaninchen (z.B. in Innenhaltung), die ausreichend Vitamin D über die Nahrung aufnehmen, würden möglicherweise keine zusätzliche, direkte UV-B-Bestrahlung benötigen.
Die höchsten gemessenen Serumkonzentrationen waren 55 ng/mL für 25(OH)D2 und 69 ng/mL für Gesamt-25(OH)D. Basierend auf früheren Ergebnissen (Chan et al., 1979) schlussfolgerten die Autoren, dass 25(OH)D-Konzentrationen über 60 ng/mL „unvorhersehbare Folgen haben könnten, besonders wenn diese über einen längeren Zeitraum aufrechterhalten werden“. In der vorliegenden Studie gab es kaum relevante Unterschiede in den iCa, Ca-, P- und Mg-Konzentrationen zwischen den Gruppen und keine Korrelationen zwischen Vitamin D- und Mineralstoff-Konzentrationen – es sei zu bedenken, ob nicht eher ein Übermaß als ein Mangel an Vitamin D ein größeres Risiko für Hauskaninchen darstellt.
Empfehlungen
Umrechnungen
1 IE (Internationale Einheit) Vitamin D3 = 1 UE (International Unit) Vitamin D3 = 0,025 µg Vitamin D3
1 µg Vitamin D3 = 40 IE Vitamin D3 = 40 IU Vitamin D3
6 8 1057
